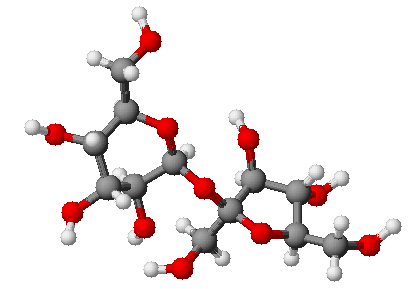
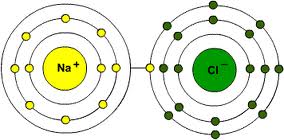
Gli elementi si uniscono tra loro (reagiscono, si dice) per formare molecole di composti vari. Non sono tutti compatibili, alcune coppie vanno più d’accordo di altre. Detto in modo molto approssimato, esistono elementi che si ritrovano con degli elettroni in più, altri con degli elettroni in meno. In natura si cerca sempre l’equilibrio: l’ideale sarebbe avere un numero di elettroni pari a quello dei protoni nel nucleo in modo che l’atomo abbia carica neutra. Invece ci si ritrova sempre con almeno un elettrone in più o in meno (e si parla di “ioni”, positivi o negativi che siano). A questo punto, visto che lo scopo di tutti è di raggiungere la carica neutra, chi ha qualcosa in più la dà a chi non ce l’ha, formando legami molecolari. L’idrogeno, ad esempio, che ha solo un protone nel nucleo, si perde sempre l’unico povero elettrone che gli gira attorno. Spesso giunge in aiuto il cloro (Cl), che ha 17 protoni nel nucleo e sempre 18 elettroni che gli orbitano intorno. Gli viene naturale offrire all’idrogeno l’elettrone in eccesso e farlo contento. I due si legano così a formare la molecola HCl, noto come acido cloridrico. Ma non vanno davvero d’accordo i due, il cloro potrebbe incontrare elementi a lui più affini, quali i metalli e i metalli alcalini.
Tipico è l’esempio del sodio (Na, dal latino natrum), che ha 11 protoni nel nucleo ma si ritrova sempre con soli 10 elettroni attorno. In natura è facile trovarlo legato all’ossigeno, che ha 8 protoni ma spesso 10 elettroni attorno. I due elettroni che l’ossigeno ha in più si legano a due atomi di sodio a formare Na2O. Se l’acido cloridrico entra in contatto col sodio legato all’ossigeno, reagisce molto facilmente perché cloro e sodio tendono a stare assieme meglio come NaCl, il sale da cucina, così come idrogeno ed ossigeno che si legano a formare acqua (infatti il nome dell’idrogeno significa “generatore di acqua”).
Alcuni elementi noti come metalli formano tra loro dei legami particolari che permettono agli elettroni di spostarsi abbastanza liberamente da un atomo all’altro delle molecole. In pratica la nube elettronica di cui si parlava per gli atomi in questo caso avvolge la molecola intera, permettendo spostamento di cariche (elettroni) al suo interno. Ma ci deve essere un motivo per farlo. Quando gli elettroni si muovono da un atomo all’altro si dice che esiste una corrente elettrica. I materiali che permettono questo vengono detti “conduttori”. Cosa spinge gli elettroni, delle cariche elettriche, a muoversi all’interno di un metallo conduttore?
| < La materia è fatta di atomi | La corrente elettrica > |